Het is al lang bekend dat alle moleculen twee gelijke en tegengestelde ladingen hebben die van elkaar gescheiden zijn door een bepaalde afstand. In het geval van dergelijke polaire moleculen valt het centrum van negatieve lading niet samen met het centrum van positieve lading. De mate van polariteit in dergelijke covalente moleculen kan worden beschreven met de term dipoolmoment, wat in wezen de maat is voor polariteit in een polaire covalente binding.
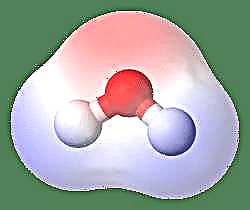
Het eenvoudigste voorbeeld van een dipool is een watermolecuul. Een watermolecuul is polair vanwege het ongelijke delen van de elektronen in een "gebogen" structuur. Het watermolecuul vormt een hoek, met waterstofatomen aan de uiteinden en zuurstof aan de top. Omdat zuurstof een hogere elektronegativiteit heeft dan waterstof, heeft de zijde van het molecuul met het zuurstofatoom een gedeeltelijke negatieve lading, terwijl de waterstof in het midden een gedeeltelijke positieve lading heeft. Hierdoor wijst de richting van het dipoolmoment naar de zuurstof.
In de taal van de natuurkunde is het elektrische dipoolmoment een maat voor de scheiding van positieve en negatieve elektrische ladingen in een ladingssysteem, dat wil zeggen een maat voor de algehele polariteit van het ladingssysteem - dwz de scheiding van de elektrische lading van de moleculen, die leidt tot een dipool. Wiskundig, en in het eenvoudige geval van twee puntladingen, één met lading + q en één met lading? Q, kan het elektrische dipoolmoment p worden uitgedrukt als: p = qd, waarbij d de verplaatsingsvector is die wijst van de negatieve lading naar de positieve lading. De elektrische dipoolmomentvector p wijst dus van de negatieve lading naar de positieve lading.
Een andere manier om ernaar te kijken is om het dipoolmoment weer te geven met de Griekse letter m, m = ed, waarbij e de elektrische lading is en d de afstand van de scheiding. Het wordt uitgedrukt in de eenheden van Debye en geschreven als D (waarbij 1 Debye = 1 x 10-18e.s.u cm). Een dipoolmoment is een vectorgrootheid en wordt daarom weergegeven door een kleine pijl met een staart in het positieve midden en de kop wijst naar een negatief middelpunt. In het geval van een watermolecuul is het dipoolmoment 1,85 D, terwijl een zoutzuurmolecuul 1,03 D is en kan worden weergegeven als:
We hebben veel artikelen geschreven over dipoolmomenten voor Space Magazine. Hier is een artikel over waar water van gemaakt is, en hier is een artikel over moleculen.
Als je meer informatie wilt over het dipoolmoment, bekijk dan deze artikelen van Hyperphysics and Science Daily.
We hebben ook een hele aflevering van Astronomy Cast opgenomen over Molecules in Space. Luister hier, aflevering 116: Molecules in Space.
Bronnen:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule